La distrofia muscolare di Duchenne
Aspetti clinici e prospettive terapeutiche

La distrofia muscolare di Duchenne (DMD) rappresenta una delle forme più severe di patologia muscolare geneticamente determinata, con stime di frequenza che, secondo i dati più recenti, si attestano intorno a uno su 3.500 nati vivi di sesso maschile.
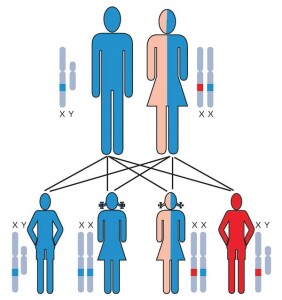
Dal punto di vista genetico è causata dalla presenza di varianti patogenetiche a carico del gene DMD, nella maggior parte dei casi di tipo “delezione” di uno o più componenti del gene chiamate esoni. In casi meno frequenti, si tratta invece di duplicazioni o varianti di singoli nucleotidi (cioè composti organici formati da una molecola di zucchero unita a una base azotata e a una o più molecole di fosfato). Tali alterazioni del codice genetico sono trasmesse per via materna, fatta eccezione per le forme de novo, essendo una patologia legata al cromosoma X che si manifesta quasi esclusivamente nel sesso maschile, nonostante esistano manifestazioni cliniche seppure di entità generalmente minore anche nelle portatrici di sesso femminile. Ciò che distingue la DMD dalla distrofia muscolare di Becker è la quantità residua di distrofina, una proteina essenziale per la conservazione della struttura del muscolo scheletrico. Infatti nella DMD le varianti genetiche definite out-of-frame, ossia che inducono una modifica radicale nella lettura delle informazioni contenute nel gene DMD, determinano una profonda riduzione della distrofina residua, tendenzialmente dallo zero al 5% rispetto alla quantità fisiologica.
 Le alterazioni istologiche e biochimiche vengono rilevate attraverso gli esami del sangue, in cui si riscontra tipicamente il netto aumento dei valori della creatina chinasi (CK) anche nel periodo neonatale, con un picco intorno ai due anni. I disturbi motori sono caratterizzati da un modesto ritardo nell’acquisizione delle tappe motorie (in particolare della capacità di camminare in autonomia) e dalla difficoltà nella corsa, con frequenti cadute durante il passo già intorno ai due-tre anni di vita. La debolezza ha una classica distribuzione di tipo pelvi-femorale, presenta limitazioni nel salto, nella salita delle scale, nell’attività fisica anche modesta e il peculiare segno dell’arrampicamento (o di Gower) nel rialzarsi da terra, una manovra di compensazione che, quando ci si trova seduti sul pavimento, è contraddistinta dalla necessità di un sostegno da parte degli arti superiori, i quali spingono prima sul pavimento e poi sulle cosce al fine di portarsi in posizione eretta. Altre manifestazioni consistono nell’andatura di tipo “anserino”, ossia con l’aumentato basculamento delle anche durante il cammino, l’iperlordosi lombare (ovvero un’accentuazione della fisiologica curva nella parte bassa della colonna vertebrale) e la pseudoipertrofia dei polpacci, che appaiono patologicamente ingrossati, rispetto al trofismo muscolare generale, a causa dell’accumulo di tessuto cicatriziale e di grasso. Spesso possono essere riscontrati anche frequenti dolori o crampi muscolari, in particolare dopo aver effettuato sforzi fisici, oppure una camminata “tallonante”, consistente in alterazioni dell’asse della caviglia e retrazioni del tendine achilleo, così come una riduzione dei riflessi osteotendinei evidenziata dall’esame neurologico. Secondo l’evoluzione naturale della malattia, la perdita della capacità di camminare in autonomia avviene intorno ai dodici-tredici anni, seppure possa essere ritardata dall’utilizzo di terapie come i corticosteroidi. Tuttavia, anche in relazione a questi ultimi, dopo la perdita del passo si assiste frequentemente a un incremento di peso, a un peggioramento della scoliosi e, di conseguenza, della funzione respiratoria. Un’altra ripercussione nota è quella cardiologica, attraverso una tipica cardiomiopatia dilatativa, ossia una riduzione della capacità del cuore di pompare sangue dovuta a uno sfiancamento delle sue pareti muscolari, e anomalie di conduzione dell’impulso elettrico all’interno dello stesso organo, che sfociano in ripetute aritmie anche severe, necessitanti spesso, con l’avanzare della patologia, di impianto di defibrillatori. Nelle fasi iniziali la cardiomiopatia è tendenzialmente asintomatica, ma quando è conclamata, vedi la tipica riduzione della “frazione d’eiezione” individuata dall’indagine ecocardiografica, come campanello d’allarme di un possibile scompenso cardiaco i soggetti possono lamentare una maggiore affaticabilità nelle attività della vita quotidiana, nausea e inappetenza, così come difficoltà respiratorie.
Le alterazioni istologiche e biochimiche vengono rilevate attraverso gli esami del sangue, in cui si riscontra tipicamente il netto aumento dei valori della creatina chinasi (CK) anche nel periodo neonatale, con un picco intorno ai due anni. I disturbi motori sono caratterizzati da un modesto ritardo nell’acquisizione delle tappe motorie (in particolare della capacità di camminare in autonomia) e dalla difficoltà nella corsa, con frequenti cadute durante il passo già intorno ai due-tre anni di vita. La debolezza ha una classica distribuzione di tipo pelvi-femorale, presenta limitazioni nel salto, nella salita delle scale, nell’attività fisica anche modesta e il peculiare segno dell’arrampicamento (o di Gower) nel rialzarsi da terra, una manovra di compensazione che, quando ci si trova seduti sul pavimento, è contraddistinta dalla necessità di un sostegno da parte degli arti superiori, i quali spingono prima sul pavimento e poi sulle cosce al fine di portarsi in posizione eretta. Altre manifestazioni consistono nell’andatura di tipo “anserino”, ossia con l’aumentato basculamento delle anche durante il cammino, l’iperlordosi lombare (ovvero un’accentuazione della fisiologica curva nella parte bassa della colonna vertebrale) e la pseudoipertrofia dei polpacci, che appaiono patologicamente ingrossati, rispetto al trofismo muscolare generale, a causa dell’accumulo di tessuto cicatriziale e di grasso. Spesso possono essere riscontrati anche frequenti dolori o crampi muscolari, in particolare dopo aver effettuato sforzi fisici, oppure una camminata “tallonante”, consistente in alterazioni dell’asse della caviglia e retrazioni del tendine achilleo, così come una riduzione dei riflessi osteotendinei evidenziata dall’esame neurologico. Secondo l’evoluzione naturale della malattia, la perdita della capacità di camminare in autonomia avviene intorno ai dodici-tredici anni, seppure possa essere ritardata dall’utilizzo di terapie come i corticosteroidi. Tuttavia, anche in relazione a questi ultimi, dopo la perdita del passo si assiste frequentemente a un incremento di peso, a un peggioramento della scoliosi e, di conseguenza, della funzione respiratoria. Un’altra ripercussione nota è quella cardiologica, attraverso una tipica cardiomiopatia dilatativa, ossia una riduzione della capacità del cuore di pompare sangue dovuta a uno sfiancamento delle sue pareti muscolari, e anomalie di conduzione dell’impulso elettrico all’interno dello stesso organo, che sfociano in ripetute aritmie anche severe, necessitanti spesso, con l’avanzare della patologia, di impianto di defibrillatori. Nelle fasi iniziali la cardiomiopatia è tendenzialmente asintomatica, ma quando è conclamata, vedi la tipica riduzione della “frazione d’eiezione” individuata dall’indagine ecocardiografica, come campanello d’allarme di un possibile scompenso cardiaco i soggetti possono lamentare una maggiore affaticabilità nelle attività della vita quotidiana, nausea e inappetenza, così come difficoltà respiratorie.
I disturbi di ventilazione, che generalmente compaiono in età adolescenziale-giovane adulta, consistono in una netta riduzione della forza della muscolatura toracica, evidenziata dal peggioramento dei parametri individuati mediante la spirometria e il monitoraggio cardiorespiratorio notturno. Quando è necessario, vengono indicati macchinari di ventilazione meccanica non invasiva e, nelle forme più gravi provocate dall’avanzamento della malattia, anche invasiva con il confezionamento di tracheostomia.
Dal punto di vista osseo, spesso una causa di perdita della deambulazione è determinata dalle fratture derivanti da cadute accidentali per il cedimento muscolare a carico degli arti inferiori, ma è pure essenziale considerare la diminuzione della densità minerale ossea (osteopenia/osteoporosi, a seconda della gravità) anche indotta dalla terapia a base di cortisone. In tale situazione le fratture possono verificarsi anche in altre sedi, come quella vertebrale, avendo come esito il progressivo peggioramento della scoliosi e di conseguenza della funzionalità polmonare.
Un aspetto ancora in fase di studio, in particolare dopo la maggiore età, è quello cognitivo-comportamentale, indagato mediante test neuropsicologici approfonditi e protocolli di ricerca che si propongono di dosare molecole nel sangue chiamate “biomarcatori di neurodegenerazione”. Nel bambino affetto da DMD è frequente una riduzione, da lieve a moderata, delle funzioni cognitive, così come, ad esempio, un’apparente maggiore incidenza di disturbi dello spettro autistico, disordini dell’attenzione con iperattività (ADHD) e ansia generalizzata.
Per quanto concerne la diagnosi, devono far sospettare una distrofinopatia: qualsiasi ritardo nell’acquisizione delle tappe psicomotorie (in particolare in bambini con anamnesi familiare positiva per patologie muscolari precoci, ancor più se del tipo “distrofia muscolare”), la presenza di indizi clinici caratteristici (segno di Gower, crampi e mialgie in età infantile con iperCKemia marcata e possibili episodi di urine color “Coca-Cola” dopo aver compiuto sforzi fisici), polpacci particolarmente ingrossati e andatura tallonante, oppure un aumento inspiegato delle transaminasi (sempre dall’età infantile, da approfondire con lo studio della CK). Per corroborare il sospetto diagnostico, risulta indispensabile la valutazione presso un centro esperto in malattie neuromuscolari, che procederà, nella maggior parte dei casi, alla pronta esecuzione di un’analisi genetica mirata, o ad ampio spettro, nell’ambito delle miopatie. Oggi la biopsia muscolare viene ancora eseguita, seppure in casi più selezionati rispetto al passato, in particolare quando è necessario identificare il significato di una variante genetica da caratterizzare con approfondimenti incentrati sulla proteina (ad esempio la distrofina) a livello del tessuto muscolare prelevato. Una volta raggiunta la diagnosi genetica, si procede alla determinazione dell’eventuale stato di portatrice della variante patogenetica anche nella madre e allo studio dei familiari. Alle portatrici, nella maggior parte dei casi asintomatiche dal punto di vista neuromuscolare, viene consigliato un regolare monitoraggio cardiologico clinico-strumentale, oltre che una consulenza genetica per la determinazione del rischio di ricorrenza della patologia nella prole e nei parenti (anche a fini preconcezionali/prenatali in caso di desiderio riproduttivo).
Lo standard di trattamento della DMD è attualmente rappresentato dalla terapia corticosteroidea, principalmente in considerazione del beneficio comportato in termini di prolungamento della capacità di camminare in autonomia e di migliorare la funzione respiratoria. Il cortisone viene generalmente iniziato precocemente, durante l’infanzia (intorno ai cinque anni di età), al dosaggio di 0.75 mg/kg al giorno per il prednisone e di 0.9 mg/kg al giorno per il deflazacort, il tutto caratterizzato da un’ampia variabilità in considerazione della tolleranza della molecola nella terapia riservata ai pazienti cronici, anche in relazione al loro progressivo aumento di peso e alla perdita del cammino. In ogni caso, sono sempre da tenere a mente i ben noti effetti collaterali dei corticosteroidi assunti cronicamente, tra i quali l’aumento di peso, la riduzione della curva di crescita staturale, il calo della densità minerale ossea, l’acne, il bruciore gastrico, la cataratta e l’alterazione del metabolismo degli zuccheri.
Per quanto riguarda la presa in carico dei ragazzi con DMD, fin da subito la riabilitazione motoria riveste un ruolo prioritario mediante l’indicazione di una terapia personalizzata in cui sia presente la ginnastica “submassimale”, ossia evitando intensità eccessive, e lo stretching articolare, in modo da ridurre il rischio di ipotrofia/atrofia muscolare, di eccessivo aumento di peso e di retrazioni. Anche la terapia occupazionale, così come la logopedia, possono essere prese in considerazione per implementare il funzionamento sociale e la comunicazione/deglutizione dei pazienti. Insieme a ciò, diversi specialisti sono coinvolti nel monitoraggio multidisciplinare della malattia: il neurologo/neuropsichiatra infantile esperto in malattie neuromuscolari, l’ortopedico e il fisiatra-fisioterapista per la scoliosi e le retrazioni articolari, oltre che per la prescrizione degli ausili e delle ortesi, il cardiologo per il monitoraggio e il trattamento della cardiomiopatia, lo pneumologo e il fisioterapista respiratorio per quanto riguarda la funzionalità polmonare e il meccanismo della tosse, il foniatra e il dietologo-nutrizionista per la deglutizione e l’apporto alimentare e infine l’endocrinologo per un’analisi regolare del quadro ormonale e del metabolismo osseo. Inoltre il consenso internazionale prevede una profilassi vaccinale antinfluenzale, antipneumococcica e antiSARS-CoV-2 (i vaccini ad mRNA, secondo le indicazioni ministeriali riguardanti i pazienti fragili), evitando i vaccini di tipo “vivo/vivo-attenuato” se vengono assunte dosi elevate di cortisone in cronico. Sempre indispensabile ricordare le precauzioni da seguire in caso di interventi chirurgici in anestesia generale, a causa del rischio di rabdomiolisi (vale a dire la distruzione massiccia del muscolo), di difficile ripresa della funzione respiratoria dopo l’estubazione e delle possibili aritmie/alterazioni cardiache nel corso dell’intervento. Per tali ragioni, prima di operazioni chirurgiche con sedazione generale, si consiglia di effettuare una valutazione multidimensionale di tipo neuromuscolare, pneumologica e cardiologica, oltre che anestesiologica. Allo stesso modo, nell’ambito emergenziale di un pronto soccorso, è necessario che il paziente affetto da DMD venga gestito secondo protocolli prestabiliti, in modo da individuare le priorità di trattamento e identificare l’eventuale opportunità di ricovero ospedaliero.
Seguendo gli standard di cura previsti per la patologia, la prognosi dei ragazzi DMD è radicalmente cambiata grazie a un netto aumento della sopravvivenza che, se fino al Duemila si attestava intorno alla terza decade, oggi può protrarsi anche al di sopra dei trentacinque anni di età.
Alcune terapie già approvate, oppure in corso di studio, sono quelle di tipo exon-skipping o mirate a mutazioni nonsenso/stop-codon, che si propongono quindi di ripristinare la “finestra di lettura” del gene DMD per portare alla formazione della proteina distrofina, tra le quali il farmaco ataluren, attualmente [giugno 2023, N.d.A.] approvato dall’Agenzia italiana del farmaco (AIFA), e “indicato per il trattamento della distrofia muscolare di Duchenne, dovuta a mutazione nonsenso del gene, nei pazienti deambulanti di età pari o superiore a due anni”, e altre in attesa di approvazione da parte dell’ente nazionale del farmaco (eteplirsen, golodirsen, viltolarsen, casimersen). Un altro approccio in fase di studio è l’inibizione dell’istone deacetilasi (HDAC) mediante un farmaco chiamato givinostat, testato con un trial di fase 3 e uno di fase 2, rispettivamente nella distrofia muscolare di Duchenne e di Becker. In aggiunta, il vamorolone, analogo corticosteroideo che si propone di ridurre gli effetti collaterali da cortisone e che risulta in corso di analisi di efficacia nel trial di fase 2b, così come la molecola CAP-1002 (in trial di fase 3 “HOPE-3”), una terapia cellulare infusionale caratterizzata da cellule allogeniche umane cardiosphere-derived (CDCs), che si suppone possano produrre fattori benefici per il muscolo riducendone la degenerazione.
Una terapia recentemente approvata dall’agenzia regolatoria del farmaco statunitense (FDA) mediante un iter accelerato [sempre nel giugno 2023, N.d.A.] è l’Elevidys (delandistrogene moxeparvovec-rokl), un trattamento basato su una singola somministrazione endovenosa di vettori adeno-virali contenenti un’informazione genetica codificante per una versione più piccola della proteina distrofina, chiamata micro-distrofina, destinata, per ora, ai soli pazienti con diagnosi di DMD deambulanti, di età compresa tra i quattro e i cinque anni, che non mostrino la delezione dell’esone 8 e/o 9 del gene. Ulteriori informazioni circa l’efficacia della terapia saranno tuttavia raccolte nel corso del trial clinico di fase 3 Embark dell’azienda farmaceutica Sarepta Therapeutics, i cui primi risultati sono attesi per la fine del 2023.







 Onlus UILDM TORINO
Onlus UILDM TORINO